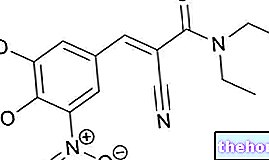
Aktive ingredienser: Nimodipine
NIMOTOP 30 mg overtrukne tabletter
NIMOTOP 30 mg / 0,75 ml orale dråber, opløsning
Nimotop indlægssedler er tilgængelige til pakningsstørrelser: - NIMOTOP 30 mg overtrukne tabletter, NIMOTOP 30 mg / 0,75 ml orale dråber, opløsning
- NIMOTOP 10 mg / 50 ml opløsning til intravenøs infusion
Indikationer Hvorfor bruges Nimotop? Hvad er det for?
Farmakoterapeutisk gruppe
Selektiv calciumkanalblokker; dihydropyridinderivat
Terapeutiske indikationer
Forebyggelse og terapi af iskæmiske neurologiske underskud relateret til cerebral vasospasme.
Kontraindikationer Når Nimotop ikke bør bruges
Nimotop må ikke administreres under graviditet eller amning og i tilfælde af overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
Nimotop bør ikke administreres samtidigt med rifampicin, da samtidig administration af rifampicin kan reducere nimodipins effekt betydeligt (se afsnittet "Interaktioner").
Alvorligt nedsat leverfunktion, og især levercirrhose, kan forårsage en stigning i biotilgængeligheden af nimodipin på grund af et fald i first pass -effekten og metabolisk clearance.Derfor bør Nimotop ikke administreres til patienter med leverfunktion. (f.eks. skrumpelever).
Samtidig behandling med orale nimodipin og antiepileptika, såsom phenobarbital, phenytoin eller carbamazepin, er kontraindiceret, da samtidig brug af disse lægemidler kan reducere nimodipins effektivitet betydeligt (se "Interaktioner").
Forholdsregler ved brug Hvad du skal vide, før du tager Nimotop
Hos meget ældre patienter med flere tilstande, ved svært nedsat nyrefunktion (glomerulær filtrering <20 ml / min) og hos patienter med alvorligt nedsat kardiovaskulær funktion, bør behovet for behandling med Nimotop overvejes med forsigtighed, og patienten bør regelmæssigt kontrolleres.
Selvom der ikke er tegn på, at behandling med Nimotop er forbundet med en stigning i intrakranielt tryk, anbefales omhyggelig overvågning i disse tilfælde eller under forhold, der er karakteriseret ved en markant stigning i vandindholdet i hjernevævet (generaliseret hjerneødem).
Nimotop bør også anvendes med forsigtighed til patienter med lavt blodtryk (systolisk blodtryk <100 mmHg).
Hos patienter med ustabil angina eller i de første 4 uger efter et akut myokardieinfarkt skal lægen vurdere den potentielle risiko (reduceret koronar perfusion og myokardial iskæmi) i forhold til den forventede fordel (forbedret cerebral perfusion).
Interaktioner Hvilke lægemidler eller fødevarer kan ændre virkningen af Nimotop
Informer din læge (eller apotek), hvis du for nylig har taget anden medicin, uden recept.
Virkninger af andre lægemidler på nimodipin
Nimodipin metaboliseres via cytokrom P450 3A4 -systemet, der er placeret både i tarmslimhinden og i leveren. Lægemidler, der vides at hæmme eller fremkalde dette enzymsystem, kan derfor ændre den første passage -effekt (efter oral administration) eller clearance af nimodipin (se "Dosis, metode og tidspunkt for administration").
Omfanget og varigheden af denne interaktion bør tages i betragtning, når nimodipin administreres samtidigt med følgende lægemidler:
Rifampicin
Erfaring med andre calciumkanalblokkere tyder på, at rifampicin fremskynder metabolismen af nimodipin gennem en enzyminduktionsproces.
Derfor kan nimodipins effektivitet reduceres betydeligt, når det administreres med rifampicin.
Anvendelse af nimodipin sammen med rifampicin er derfor kontraindiceret (se "Kontraindikationer").
Antiepileptika fremkalder cytochrom P450 3A4 -systemet, såsom phenobarbital, phenytoin eller carbamazepin
Tidligere kronisk behandling med de antiepileptiske lægemidler phenobarbital, phenytoin eller carbamazepin reducerer markant biotilgængeligheden af oralt administreret nimodipin. Derfor er samtidig behandling med disse lægemidler og oral nimodipin kontraindiceret (se "Kontraindikationer").
Hæmmere af cytokrom P450 3A4 -systemet
Når det administreres samtidigt med følgende hæmmere af cytochrom P450 3A4-systemet, skal blodtrykket overvåges, og om nødvendigt bør en reduktion af nimodipindosis overvejes (se "Dosis, metode og tidspunkt for administration").
Makrolidantibiotika (f.eks. Erythromycin)
Der er ikke udført interaktionsundersøgelser mellem makrolidantibiotika og nimodipin. Nogle makrolidantibiotika er kendte hæmmere af cytochrom P450 3A4 -systemet, og muligheden for en interaktion på dette niveau kan ikke udelukkes. Derfor bør makrolidantibiotika ikke anvendes i kombination med nimodipin (se "Særlige advarsler").
Selvom azithromycin strukturelt er relateret til makrolidklassen af antibiotika, er det ikke en hæmmer af cytochrom CYP 3A4 -systemet.
HIV -proteasehæmmere (f.eks. Ritonavir)
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og anti-HIV-proteasehæmmere. Visse lægemidler i denne klasse er rapporteret at være stærke hæmmere af cytochrom P450 3A4 -systemet. Af denne grund kan muligheden for en markant og klinisk relevant stigning i plasmakoncentrationen af nimodipin ikke administreres samtidigt med et af disse lægemidler. (se "Særlige advarsler").
Azolsvampemidler (f.eks. Ketoconazol)
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og ketoconazol. Azol-antifungale midler er kendt for at hæmme cytochrom P450 3A4-systemet, og forskellige interaktioner er blevet rapporteret for andre dihydropyridinkalciumkanalblokkere. Derfor kan en betydelig forøgelse af systemisk biotilgængelighed ikke udelukkes ved samtidig administration af oral nimodipin. fald i first -pass metabolisme (se "Særlige advarsler").
Nefazodon
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og nefazodon. Dette antidepressive lægemiddel er kendt for at være en potent hæmmer af cytokrom P450 3A4 -systemet. Hvis nefazodon administreres samtidig med nimodipin, kan en betydelig stigning i plasmakoncentrationen af nimodipin derfor ikke udelukkes (se "Særlige advarsler"
Fluoxetin
Samtidig administration af nimodipin med antidepressiva fluoxetin ved steady state resulterede i en stigning på cirka 50% i plasmakoncentrationer af nimodipin. Koncentrationen af fluoxetin faldt markant, mens koncentrationen af dets aktive metabolit norfluoxetin ikke blev påvirket (se "Særlige advarsler"). ").
Quinupristin / dalfopristin
Baseret på erfaring med calciumkanalblokker nifedipin, kan samtidig administration af nimodipin og quinupristin / dalfopristin føre til øgede plasmakoncentrationer af nimodipin (se "Særlige advarsler").
Cimetidin
Samtidig administration af nimodipin og cimetidin (en H2-antagonist) kan føre til en stigning i plasmakoncentrationen af nimodipin (se "Særlige advarsler").
Valproinsyre
Samtidig administration af nimodipin og valproinsyre (et antikonvulsivt middel) kan føre til en stigning i plasmakoncentrationen af nimodipin (se "Særlige advarsler").
Yderligere interaktioner
Nortriptylin
Den samtidige anvendelse af nimodipin og nortriptylin ved steady state førte til et beskedent fald i koncentrationen af nimodipin uden at påvirke plasmaniveauerne af nortriptylin.
Virkninger af nimodipin på andre lægemidler
Antihypertensive lægemidler
Nimodipin kan øge den hypotensive virkning af samtidig administrerede antihypertensive lægemidler, f.eks.
- diuretika
- β-blokkere
- ACE -hæmmere
- A1 -antagonister
- andre calciumkanalblokkere
- α-blokkere
- PDE5 -hæmmere
- a-methyldopa
Hvis en sådan sammenhæng er uundgåelig, kræves særlig omhyggelig patientovervågning.
Zidovudine
I et abestudie inducerede samtidig intravenøs administration af anti-HIV-lægemidlet zidovudin og bolus nimodipin en signifikant stigning i AUC for zidovudin med en signifikant reduktion i dets distributions- og clearancevolumen.
Mad interaktioner
Grapefrugtjuice
Grapefrugtjuice hæmmer cytokrom P450 3A4 -systemet.
Den samtidige indtagelse af grapefrugtjuice og diiprodipyridin calciumkanalblokkere øger plasmakoncentrationen og virkningsvarigheden af sidstnævnte på grund af et fald i dets første gennemgangsmetabolisme eller dets clearance. Som en konsekvens af dette kan den antihypertensive effekt af nimodipin forstærkes . Dette fænomen kan vare i mindst 4 dage efter sidste indtagelse af grapefrugtsaft. Indtagelse af grapefrugt eller grapefrugtsaft bør derfor undgås under behandling med nimodipin (se "Dosis, metode og tidspunkt for administration").
Sager, hvor en interaktion ikke er blevet fremhævet
Haloperidol
Samtidig administration af steady-state nimodipin til patienter i langtidsbehandling med haloperidol afslørede ikke noget potentiale for gensidige interaktioner.
Samtidig administration af oral nimodipin og diazepam, digoxin, glibenclamid, indomethacin, ranitidin og warfarin afslørede ingen mulige gensidige interaktioner.
Advarsler Det er vigtigt at vide, at:
Nimodipin metaboliseres via cytokrom P450 3A4 -systemet. Lægemidler, der vides at hæmme eller inducere dette enzymsystem, kan derfor ændre den første passeringseffekt eller clearance af nimodipin (se "Interaktioner" og "Dosis, metode og administrationstidspunkt").
Lægemidler, der vides at hæmme cytochrom P450 3A4 -systemet og derfor kan forårsage en stigning i plasmakoncentrationen af nimodipin, er f.eks.
- makrolidantibiotika (f.eks. erythromycin)
- HIV -proteasehæmmere (f.eks. Ritonavir)
- azol -svampemidler (f.eks. ketoconazol)
- antidepressiva nefazodon og fluoxetin
- quinupristin / dalfopristin
- cimetidin
- valproinsyre.
Ved samtidig administration af disse lægemidler bør blodtrykket overvåges, og om nødvendigt bør en reduktion af nimodipindosis overvejes.
Yderligere, for nimodipin oral opløsning:
Nimotop 30 mg / 0,75 ml orale dråber, opløsning indeholder 48,06 vol% ethanol (alkohol), hvilket svarer til 4,3 g pr. Daglig dosis (9 ml). Dette kan være skadeligt for mennesker, der lider af alkoholisme eller lider af nedsat alkoholstofskifte, og bør også tages i betragtning hos gravide eller ammende kvinder, børn og højrisikogrupper, såsom patienter med leversygdom eller epilepsi. denne medicin kan ændre virkningen af andre lægemidler (se "Interaktioner") samt evnen til at føre motorkøretøj og betjene maskiner (se "Evne til at føre bil og betjene maskiner").Denne medicin indeholder også hydrogeneret polyhydric ricinusolie, som kan forårsage mavebesvær og diarré.
Graviditet og amning
Spørg din læge eller apotek til råds, før du tager medicin.
Graviditet
Der er ikke tilstrækkelige kontrollerede undersøgelser hos gravide kvinder. Hvis det anses for nødvendigt at administrere Nimotop under graviditet, bør de forventede fordele og potentielle risici overvejes nøje i forhold til sværhedsgraden af det kliniske billede.
Fodringstid
Det har vist sig, at nimodipin og dets metabolitter udskilles i modermælk i en koncentration af samme størrelsesorden som i moderplasmaet. Mødre rådes til ikke at amme, mens de tager stoffet.
Fertilitet
I enkelte tilfælde af in vitro-befrugtning har calciumkanalblokkere været forbundet med reversible biokemiske ændringer i sædhovedet, hvilket muligvis kan resultere i nedsat sædfunktion. Relevansen af dette fund er ukendt ved kortvarig behandling
Virkninger på evnen til at føre motorkøretøj og betjene maskiner
I princippet kan evnen til at føre motorkøretøj og betjene maskiner forringes på grund af mulig svimmelhed.
Derudover til Nimotop orale dråber, opløsning:
Mængden af alkohol i dette lægemiddel kan påvirke din evne til at føre motorkøretøj og betjene maskiner (se "Særlige advarsler").
For dem der dyrker sport:
Brug af medicin, der indeholder ethylalkohol, kan bestemme positive dopingtest i forhold til alkoholkoncentrationsgrænserne angivet af nogle sportsforbund.
Dosering og anvendelsesmåde Sådan bruges Nimotop: Dosering
Dosering
Medmindre andet er foreskrevet, er den gennemsnitlige daglige dosis 30 mg x 3 gange (1 tablet x 3 gange eller 0,75 ml opløsning x 3 gange).
I tilfælde af Nimotop 30 mg / 0,75 ml orale dråber, opløsning, 0,75 ml opløsning er lig med 30 mg nimodipin og svarer til dråber fyldt op til mærket.
Hos patienter, der udvikler bivirkninger, bør dosis reduceres efter behov, eller behandlingen skal afbrydes.
I tilfælde af samtidig administration med inhibitorer eller inducere af CYP 3A4 -systemet kan dosismodulation være nødvendig (se "Interaktioner").
Ved profylakse og behandling af iskæmiske neurologiske underskud som følge af cerebral vasospasme forårsaget af subarachnoid blødning anbefales det efter parenteral behandling at fortsætte administrationen af nimodipin oralt i ca. 7 dage (60 mg - 2 tabletter på 30 mg eller 1, 5 ml opløsning svarende til 2 dråber fyldt op til mærket - 6 gange om dagen med 4 timers mellemrum
Særlige populationer
Nimotops sikkerhed og virkning hos patienter under 18 år er ikke fastslået.
Patienter med nedsat leverfunktion
Alvorligt nedsat leverfunktion, og især levercirrhose, kan forårsage en stigning i biotilgængeligheden af nimodipin på grund af et fald i first pass -effekten og metabolisk clearance.Farmakologiske virkninger og uønskede virkninger, såsom sænkning af arteriet blodtryk, kan være mere udtalt hos disse patienter.
I disse tilfælde bør dosis reduceres, eller om nødvendigt overvejes at afbryde behandlingen.
Patienter med nedsat nyrefunktion
Hos patienter med svært nedsat nyrefunktion (glomerulær filtrering <20 ml / min) bør behovet for behandling med Nimotop overvejes med forsigtighed, og patienten skal regelmæssigt overvåges.
I tilfælde af alvorlig nedsat nyrefunktion kan eventuelle uønskede virkninger, såsom sænkning af blodtryk, være mere udtalte; i disse tilfælde bør dosis om nødvendigt reduceres eller behandlingen afbrydes.
Indgivelsesmåde
Nimotop skal tages mellem måltiderne, idet tabletterne tages med lidt væske, og dråberne fortyndes i lidt vand.
Tag ikke med grapefrugtsaft (se "Interaktioner").
Nedsænk ikke drypperen i vand, og skyl den ikke.
Efter at have lagt dråberne i vandet, sættes dråberen tilbage i flasken.
Intervallet mellem enkeltadministrationer bør ikke være mindre end 4 timer.
Overdosering Hvad skal jeg gøre, hvis du har taget for meget Nimotop
Symptomer på forgiftning:
Akutte overdosis symptomer, der skal overvejes, er: markant hypotension, takykardi eller bradykardi; gastrointestinale forstyrrelser og kvalme.
Behandling af forgiftning
I tilfælde af akut overdosering skal administration af nimodipin afbrydes øjeblikkeligt. Nødforanstaltninger skal sigte mod at fjerne symptomerne.
Maveskylning med tilsætning af aktivt kul kan betragtes som en nødforanstaltning. I tilfælde af alvorlig hypotension kan dopamin eller noradrenalin administreres intravenøst. Da der ikke kendes nogen specifik modgift, bør behandling af bivirkninger sigte mod at fjerne de vigtigste symptomer.
I tilfælde af utilsigtet indtagelse / indtagelse af en overdreven dosis Nimotop, skal du straks underrette din læge eller gå til det nærmeste hospital.
HVIS DU ER I tvivl om at bruge NIMOTOP, KONTAKTER DIN LÆGE ELLER FARMACIST.
Bivirkninger Hvad er bivirkningerne af Nimotop
Som al anden medicin kan Nimotop forårsage bivirkninger, men ikke alle får bivirkninger.
Tabel 1 viser de bivirkninger, der er rapporteret med nimodipin i kliniske undersøgelser med nimodipin under indikationen "Forebyggelse og behandling af iskæmiske neurologiske underskud relateret til cerebral vasospasme induceret af subaraknoid blødning", sorteret efter frekvenskategorier i henhold til CIOMS III (i placebokontrolleret undersøgelser 703 patienter blev behandlet med nimodipin og 692 med placebo; i de ukontrollerede undersøgelser blev 2.496 patienter behandlet med nimodipin; status 31. august 2005).
Inden for hver frekvensklasse rapporteres bivirkninger i faldende sværhedsgrad.
Frekvenserne er defineret som følger:
meget almindelig (≥ 1/10)
almindelig (≥ 1/100 til <1/10),
ikke almindelig (≥ 1 / 1.000 til <1/100),
sjælden (≥ 1 / 10.000 til <1 / 1.000),
meget sjælden (<1 / 10.000).
Tabel 1: Bivirkninger rapporteret hos patienter i kliniske undersøgelser under indikationen "Forebyggelse og behandling af iskæmiske neurologiske underskud relateret til cerebral vasospasme".
Tabel 2 viser de bivirkninger, der er rapporteret med nimodipin i kliniske forsøg med nimodipin under indikationen "Behandling af iskæmiske neurologiske underskud (nedsat hjernefunktion hos ældre, IBFO)" og rapporteret i "post-marketing erfaring", sorteret efter frekvenskategorier i henhold til til CIOMS III (i de placebokontrollerede undersøgelser blev 1.594 patienter behandlet med nimodipin og 1.558 med placebo; i de ukontrollerede undersøgelser blev 8.049 patienter behandlet med nimodipin; status 20. oktober 2005).
Inden for hver frekvensklasse rapporteres bivirkninger i faldende sværhedsgrad.
Frekvenserne er defineret som følger:
almindelig (≥ 1/100 til <1/10),
ikke almindelig (≥ 1 / 1.000 til <1/100),
sjælden (≥ 1 / 10.000 til <1 / 1.000),
meget sjælden (<1 / 10.000).
Tabel 2: Bivirkninger rapporteret hos patienter i kliniske forsøg "Behandling af iskæmiske neurologiske underskud (nedsat hjernefunktion hos ældre, IBFO)"
Overholdelse af instruktionerne i indlægssedlen reducerer risikoen for bivirkninger.
Hvis en af bivirkningerne bliver alvorlig, eller hvis du bemærker nogen bivirkninger, der ikke er anført i denne indlægsseddel, skal du informere din læge eller apoteket.
Udløb og opbevaring
Udløbsdato: se udløbsdatoen, der er trykt på pakken.
Udløbsdatoen refererer til produktet i intakt emballage, korrekt opbevaret.
Advarsel: brug ikke medicinen efter den udløbsdato, der står på pakningen.
Udløbsdatoen refererer til den sidste dag i måneden.
Særlige opbevaringsforhold
Tabletter: ingen
Orale dråber, opløsning: beskyttes mod lys / må ikke nedkøles
Lægemidler bør ikke bortskaffes via spildevand eller husholdningsaffald. Spørg din apotek om, hvordan du skal bortskaffe medicin, du ikke længere bruger. Dette vil hjælpe med at beskytte miljøet.
Opbevar denne medicin utilgængeligt for børn.
Sammensætning
NIMOTOP 30 mg overtrukne tabletter
en overtrukket tablet indeholder:
aktiv ingrediens: nimodipin 30 mg.
Hjælpestoffer: mikrogranulær cellulose, povidon, crospovidon, magnesiumstearat, majsstivelse, hypromellose, macrogol 4000, titandioxid, gult jernoxid.
NIMOTOP 30 mg / 0,75 ml orale dråber, opløsning
0,75 ml Nimotop orale dråber indeholder:
aktiv ingrediens: nimodipin 30 mg.
Hjælpestoffer: hydrogeneret polyvalent ricinusolie, ethylalkohol.
Farmaceutisk form og indhold
36 overtrukne tabletter på 30 mg
1 flaske med 25 ml orale dråber med drypper.
Indlægsseddel: AIFA (Italian Medicines Agency). Indhold offentliggjort i januar 2016. De foreliggende oplysninger er muligvis ikke opdaterede.
For at få adgang til den mest opdaterede version er det tilrådeligt at få adgang til webstedet AIFA (Italian Medicines Agency). Ansvarsfraskrivelse og nyttige oplysninger.
01.0 LÆGEMIDLETS NAVN
NIMOTOP
02.0 KVALITATIV OG KVANTITATIV SAMMENSÆTNING
NIMOTOP 30 mg overtrukne tabletter en overtrukket tablet indeholder:
aktiv ingrediens: nimodipin 30 mg.
NIMOTOP 30 mg / 0,75 ml orale dråber, opløsning 0,75 ml opløsning indeholder:
aktiv ingrediens: nimodipin 30 mg.
Den fulde liste over hjælpestoffer findes i afsnit 6.1.
03.0 LÆGEMIDDELFORM
Coatet tablet. Orale dråber, opløsning.
04.0 KLINISKE OPLYSNINGER
04.1 Terapeutiske indikationer
Forebyggelse og terapi af iskæmiske neurologiske underskud relateret til cerebral vasospasme.
04.2 Dosering og indgivelsesmåde
Særlige populationer
Nimotops sikkerhed og virkning hos patienter under 18 år er ikke fastslået.
Dosering
Medmindre andet er foreskrevet, er den anbefalede daglige dosis 30 mg x 3 gange (1 tablet eller 0,75 ml opløsning x 3 gange). 0,75 ml opløsning er lig med 30 mg nimodipin og svarer til drypperen fyldt op til mærket.
Hos patienter, der udvikler bivirkninger, bør dosis reduceres efter behov, eller behandlingen skal afbrydes.
I tilfælde af samtidig administration med hæmmere eller inducere af CYP 3A4 -systemet kan dosismodulation være nødvendig (se pkt. 4.5).
Ved profylakse og behandling af iskæmiske neurologiske underskud som følge af cerebral vasospasme forårsaget af subarachnoid blødning anbefales det efter parenteral behandling at fortsætte administrationen af nimodipin oralt i ca. 7 dage (60 mg - 2 tabletter på 30 mg eller 1, 5 ml opløsning, svarende til 2 dråber fyldt op til mærket - 6 gange om dagen, med 4 timers mellemrum).
Patienter med nedsat leverfunktion
Alvorligt nedsat leverfunktion, og især levercirrhose, kan forårsage en stigning i biotilgængeligheden af nimodipin på grund af et fald i first pass -effekten og metabolisk clearance.Farmakologiske virkninger og uønskede virkninger, såsom sænkning af blodtryk, kan være mere udtalte hos disse patienter.
I disse tilfælde bør dosis reduceres, eller om nødvendigt overvejes at afbryde behandlingen.
Patienter med nedsat nyrefunktion
Hos patienter med svært nedsat nyrefunktion (glomerulær filtrering
I tilfælde af alvorlig nedsat nyrefunktion kan eventuelle uønskede virkninger, såsom sænkning af blodtryk, være mere udtalte; i disse tilfælde bør dosis om nødvendigt reduceres eller behandlingen afbrydes.
Indgivelsesmåde
Nimotop skal tages mellem måltiderne, tabletterne med lidt væske, dråberne fortyndes i lidt vand.
Tag ikke med grapefrugtsaft (se pkt. 4.5).
Nedsænk ikke dråben i vandet, og skyl det ikke. Efter at have lagt dråberne i vandet, skal du returnere dråben til flasken.
Intervallet mellem enkeltadministrationer bør ikke være mindre end 4 timer.
04.3 Kontraindikationer
Nimotop må ikke administreres under graviditet eller amning og i tilfælde af overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
Samtidig brug af nimodipin og rifampicin er kontraindiceret, da samtidig brug af rifampicin kan reducere nimodipins effektivitet betydeligt (se pkt. 4.5).
Samtidig behandling med orale nimodipin og antiepileptika, såsom phenobarbital, phenytoin eller carbamazepin, er kontraindiceret, da samtidig brug af disse lægemidler kan reducere nimodipins effekt betydeligt (se pkt. 4.5).
Alvorligt nedsat leverfunktion, og især levercirrhose, kan forårsage en stigning i biotilgængeligheden af nimodipin på grund af et fald i first pass -effekten og metabolisk clearance.Farmakologiske virkninger og uønskede virkninger, såsom sænkning af blodtryk, kan være mere udtalte hos disse patienter.
I disse tilfælde bør dosis reduceres, eller om nødvendigt overvejes at afbryde behandlingen.
04.4 Særlige advarsler og passende forholdsregler ved brug
Hos meget ældre patienter med flere patologier ved alvorlig nedsat nyrefunktion (glomerulær filtrering
Selvom der ikke er tegn på, at Nimotop -behandling er forbundet med en stigning i intrakranielt tryk, anbefales omhyggelig overvågning i disse tilfælde eller under forhold, der er karakteriseret ved en stigning i vandindholdet i hjernevævet (generaliseret hjerneødem).
Nimotop bør også anvendes med forsigtighed til patienter med lavt blodtryk (systolisk blodtryk
Hos patienter med ustabil angina eller i de første 4 uger efter et akut myokardieinfarkt skal lægen vurdere den potentielle risiko (reduceret koronar perfusion og myokardial iskæmi) i forhold til den forventede fordel (forbedret cerebral perfusion).
Nimodipin metaboliseres via cytokrom P450 3A4 -systemet. Lægemidler, der vides at hæmme eller inducere dette enzymsystem, kan derfor ændre den første passeringseffekt eller clearance af nimodipin (se afsnit 4.2 og 4.5).
Lægemidler, der vides at hæmme cytochrom P450 3A4 -systemet og derfor kan forårsage en stigning i plasmakoncentrationen af nimodipin, er f.eks.
- makrolidantibiotika (f.eks. erythromycin)
- anti-HIV-proteasehæmmere (f.eks. ritonavir)
- azol -svampemidler (f.eks. ketoconazol)
- antidepressiva nefazodon og fluoxetin
- quinupristin / dalfopristin
- cimetidin
- valproinsyre.
Ved samtidig administration af disse lægemidler skal blodtrykket overvåges, og om nødvendigt bør en reduktion af nimodipindosis overvejes.
Yderligere, for nimodipin oral opløsning: Nimotop 30 mg / 0,75 ml orale dråber, indeholder opløsningen 48,06 vol% ethanol (alkohol), hvilket svarer til op til 4,3 g pr. Daglig dosis (9 ml). Dette kan være skadeligt for mennesker, der lider af alkoholisme eller lider af nedsat alkoholstofskifte, og bør også tages i betragtning hos gravide eller ammende kvinder, børn og højrisikogrupper, såsom patienter med leversygdom eller epilepsi.Mængden af alkohol i dette lægemiddel kan ændre virkningen af andre lægemidler (se pkt. 4.5) samt evnen til at føre motorkøretøj og betjene maskiner (se afsnit 4.7) Dette lægemiddel indeholder også hydrogeneret polyhydrisk ricinusolie, maveforstyrrelser og diarré.
04.5 Interaktioner med andre lægemidler og andre former for interaktion
Virkninger af andre lægemidler på nimodipin
Nimodipin metaboliseres via cytokrom P450 3A4 -systemet, der er placeret både i tarmslimhinden og i leveren. Lægemidler, der vides at hæmme eller inducere dette enzymsystem, kan derfor ændre den første passeringseffekt eller clearance af nimodipin (se pkt.4.2."Patienter med nedsat leverfunktion").
Omfanget og varigheden af denne interaktion bør tages i betragtning, når nimodipin administreres samtidigt med følgende lægemidler:
Rifampicin
Erfaring med andre calciumkanalblokkere tyder på, at rifampicin fremskynder metabolismen af nimodipin gennem en enzyminduktionsproces. Derfor kan nimodipins effektivitet reduceres betydeligt, når det administreres med rifampicin.
Anvendelse af nimodipin sammen med rifampicin er derfor kontraindiceret (se pkt. 4.3).
Antiepileptika fremkalder cytochrom P450 3A4 -systemet, såsom phenobarbital, phenytoin eller carbamazepin.
Tidligere kronisk behandling med de antiepileptiske lægemidler phenobarbital, phenytoin eller carbamazepin reducerer markant biotilgængeligheden af oralt administreret nimodipin. Samtidig behandling med disse lægemidler og oral nimodipin er derfor kontraindiceret (se pkt. 4.3).
Hæmmere af cytokrom P450 3A4 -systemet
Ved samtidig administration af følgende hæmmere af cytochrom P450 3A4-systemet skal blodtrykket overvåges, og om nødvendigt bør en dosisreduktion af nimodipin overvejes (se pkt.4.2).
Makrolidantibiotika (f.eks. Erythromycin)
Der er ikke udført interaktionsundersøgelser mellem makrolidantiobiotika og nimodipin. Nogle makrolidantibiotika er kendte hæmmere af cytochrom P450 3A4 -systemet, og muligheden for en interaktion på dette niveau kan ikke udelukkes. Derfor bør makrolidantibiotika ikke anvendes i kombination med nimodipin (se pkt. 4.4).
Selvom azithromycin strukturelt er relateret til makrolidklassen af antibiotika, er det ikke en hæmmer af cytochrom CYP 3A4 -systemet.
HIV -proteasehæmmere (f.eks. Ritonavir)
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og anti-HIV-proteasehæmmere. Nogle lægemidler i denne klasse er rapporteret at være stærke hæmmere af cytokrom P450 3A4 -systemet. Af denne grund kan muligheden for en markant og klinisk relevant stigning i plasmakoncentrationen af nimodipin ikke udelukkes, når det administreres samtidigt med et af disse lægemidler (se pkt. 4.4).
Azolsvampemidler (f.eks. Ketoconazol)
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og ketoconazol. Azolsvampemidler er kendt for at hæmme cytochrom P450 3A4 -systemet, og forskellige interaktioner er blevet rapporteret for andre dihydropyridinkalciumkanalblokkere. Ved samtidig administration med oral nimodipin kan en betydelig stigning i den systemiske biotilgængelighed af nimodipin på grund af et fald i first-pass metabolisme ikke udelukkes (se pkt. 4.4).
Nefazodon
Der er ikke udført fuldgyldige undersøgelser for at undersøge den potentielle interaktion mellem nimodipin og nefazodon. Dette antidepressive lægemiddel er kendt for at være en potent hæmmer af cytokrom P450 3A4 -systemet. Når nefazodon administreres samtidigt med nimodipin, kan en betydelig stigning i plasmakoncentrationen af nimodipin derfor ikke udelukkes (se pkt. 4.4).
Fluoxetin
Samtidig administration af nimodipin og antidepressiva fluoxetin ved steady state resulterede i en stigning på cirka 50% i plasmaniveauer af nimodipin. Koncentrationen af fluoxetin faldt markant, mens koncentrationen af dets aktive metabolit norfluoxetin ikke blev påvirket (se pkt. 4.4) .
Quinupristin / dalfopristin
Baseret på erfaring med calciumkanalblokkeren nifedipin, kan samtidig administration af nimodipin og quinupristin / dalfopristin føre til øgede plasmakoncentrationer af nimodipin (se pkt. 4.4).
Cimetidin
Samtidig administration af nimodipin og cimetidin (en H2-antagonist) kan føre til en stigning i plasmakoncentrationen af nimodipin (se pkt. 4.4).
Valproinsyre
Samtidig administration af nimodipin og valproinsyre (et antikonvulsivt middel) kan føre til en stigning i plasmakoncentrationen af nimodipin (se pkt. 4.4).
Yderligere interaktioner
Nortriptylin
Den samtidige anvendelse af nimodipin og nortriptylin ved steady state førte til et beskedent fald i koncentrationen af nimodipin uden at påvirke plasmaniveauerne af nortriptylin.
Virkninger af nimodipin på andre lægemidler
Antihypertensive lægemidler
Nimodipin kan øge den hypotensive virkning af samtidig administrerede antihypertensive lægemidler, f.eks.
- diuretika
- betablokkere
- ACE -hæmmere - A1 -antagonister
- andre calciumkanalblokkere
- α-blokkere
- PDE5 -hæmmere
- a-methyldopa
Hvis en sådan sammenhæng er uundgåelig, kræves særlig omhyggelig patientovervågning.
Zidovudine
I et abestudie inducerede samtidig intravenøs administration af anti-HIV-lægemidlet zidovudin og bolus nimodipin en signifikant stigning i AUC for zidovudin med en signifikant reduktion i dets distributions- og clearancevolumen.
Mad interaktioner
Grapefrugtjuice
Grapefrugtjuice hæmmer cytokrom P450 3A4 -systemet. Den samtidige indtagelse af grapefrugtjuice og diiprodipyridin calciumkanalblokkere øger plasmakoncentrationen og virkningsvarigheden af sidstnævnte på grund af et fald i dets første gennemgangsmetabolisme eller dets clearance. Som en konsekvens af dette kan den antihypertensive effekt af nimodipin forstærkes . Dette fænomen kan vare i mindst 4 dage efter sidste indtagelse af grapefrugtsaft Indtagelse af grapefrugt eller grapefrugtsaft bør derfor undgås under behandling med nimodipin (se pkt. 4.2).
Sager, hvor en interaktion ikke er blevet fremhævet
Haloperidol
Samtidig administration af steady-state nimodipin til patienter i langtidsbehandling med haloperidol afslørede ikke noget potentiale for gensidige interaktioner.
Samtidig administration af oral nimodipin og diazepam, digoxin, glibenclamid, indomethacin, ranitidin og warfarin afslørede ingen mulige gensidige interaktioner.
04.6 Graviditet og amning
Graviditet
Der er ikke tilstrækkelige kontrollerede undersøgelser hos gravide kvinder.
Hvis det anses for nødvendigt at administrere Nimotop under graviditet, bør de forventede fordele og potentielle risici overvejes nøje i forhold til sværhedsgraden af det kliniske billede.
Fodringstid
Det har vist sig, at Nimodipine og dets metabolitter udskilles i modermælk i en koncentration af samme størrelsesorden som den, der findes i moderplasma. Mødre rådes til ikke at amme, mens de tager medicinen.
Fertilitet
I enkelte tilfælde af in vitro-befrugtning har calciumkanalblokkere været forbundet med reversible biokemiske ændringer i sædhovedet, hvilket muligvis kan resultere i nedsat sædfunktion. Relevansen af dette fund er ukendt ved kortvarig behandling.
04.7 Virkninger på evnen til at føre motorkøretøj og betjene maskiner
I princippet kan evnen til at føre motorkøretøj og betjene maskiner blive nedsat i forbindelse med den mulige forekomst af svimmelhed.
Derudover til Nimotop orale dråber, opløsning:
Mængden af alkohol i dette lægemiddel kan påvirke evnen til at føre motorkøretøj og betjene maskiner (se pkt. 4.4).
04.8 Bivirkninger
Tabel 1 viser de bivirkninger, der er rapporteret med nimodipin i kliniske undersøgelser med nimodipin under indikationen "Forebyggelse og behandling af iskæmiske neurologiske underskud relateret til cerebral vasospasme induceret af subaraknoid blødning", sorteret efter frekvenskategorier i henhold til CIOMS III (i placebokontrolleret undersøgelser 703 patienter blev behandlet med nimodipin og 692 med placebo; i de ukontrollerede undersøgelser blev 2.496 patienter behandlet med nimodipin; status 31. august 2005).
Inden for hver frekvensklasse rapporteres bivirkninger i faldende sværhedsgrad.
Frekvenser defineres som: meget almindelig (≥ 1/10), almindelig (≥ 1/100,
Tabel 1: Bivirkninger rapporteret hos patienter i kliniske undersøgelser under indikationen "Forebyggelse og behandling af iskæmiske neurologiske underskud relateret til cerebral vasospasme".
Tabel 2 viser de bivirkninger, der er rapporteret med nimodipin i kliniske undersøgelser med nimodipin på "indikationen"Behandling af iskæmiske neurologiske underskud (nedsat hjernefunktion hos "ældre, IBFO)" og rapporteret efter markedsføring, sorteret efter frekvenskategorier i henhold til CIOMS III (i de placebokontrollerede undersøgelser blev 1.594 patienter behandlet med nimodipin og 1.558 med placebo; i ukontrollerede undersøgelser blev 8.049 patienter behandlet med nimodipin; status 20. oktober 2005).
Inden for hver frekvensklasse rapporteres bivirkninger i faldende sværhedsgrad.
Frekvenser defineres som følger: almindelig (≥ 1/100,
Tabel 2: Bivirkninger rapporteret hos patienter i kliniske forsøg Indikation "Behandling af iskæmiske neurologiske underskud (nedsat hjernefunktion hos ældre, IBFO)".
Indberetning af formodede bivirkninger
Rapportering af formodede bivirkninger, der opstår efter godkendelse af lægemidlet, er vigtig, da det muliggør løbende overvågning af lægemidlets fordel / risiko -balance. Sundhedspersonale anmodes om at rapportere alle formodede bivirkninger via det nationale rapporteringssystem. "Adresse https: //www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
04.9 Overdosering
Symptomer på forgiftning:
Akutte overdosis symptomer, der skal overvejes, er: markant hypotension, takykardi eller bradykardi; gastrointestinale forstyrrelser og kvalme.
Behandling af forgiftning
I tilfælde af akut overdosering skal administration af nimodipin afbrydes øjeblikkeligt. Nødforanstaltninger skal sigte mod at fjerne symptomerne.
Maveskylning med tilsætning af aktivt kul kan betragtes som en nødforanstaltning. I tilfælde af alvorlig hypotension kan dopamin eller noradrenalin administreres intravenøst. Da der ikke kendes nogen specifik modgift, bør behandling af bivirkninger sigte mod at fjerne de vigtigste symptomer.
Indberetning af formodede bivirkninger
Rapportering af formodede bivirkninger, der opstår efter godkendelse af lægemidlet, er vigtig, da det muliggør løbende overvågning af lægemidlets fordel / risiko -balance.Professionelle sundhedspersoner anmodes om at rapportere alle formodede bivirkninger via det nationale rapporteringssystem. "Gadeadresse
www.aifa.gov.it/responsabili
05.0 FARMAKOLOGISKE EGENSKABER
05.1 Farmakodynamiske egenskaber
Farmakoterapeutisk gruppe: selektiv calciumkanalblokker, dihydropyridinderivat.
ATC -kode: C08CA06.
Nimodipine er en calciumantagonist tilhørende 1,4 dihydropyridin -klassen, som adskiller sig fra andre calciumantagonister på grund af sin markante virkningsselektivitet i det cerebrale distrikt.
Takket være sin høje lipofilitet krydser nimodipin let blod -hjerne -barrieren. I dyreforsøg har nimodipin vist sig at binde med høj affinitet og selektivitet til L + type Ca ++-kanaler og derved blokere den intracellulære tilstrømning af calcium over membranen.
Nimodipine beskytter neuroner og stabiliserer deres funktionalitet, fremmer cerebral blodgennemstrømning og øger modstanden mod iskæmi gennem en virkning på neuronale og cerebrovaskulære receptorer forbundet til calciumkanaler.
I patologiske tilstande forbundet med en stigning i den intracytoplasmatiske tilstrømning af calcium til nerveceller, for eksempel under cerebral iskæmi, menes nimodipin at forbedre stabiliteten og funktionel kapacitet af disse cellulære elementer.
Den selektive blokade af calciumkanaler i nogle hjerneområder, såsom hippocampus og cortex, kan måske forklare nimodipins positive effekt på læring og hukommelsesunderskud observeret i flere dyremodeller.
Den samme molekylære mekanisme er sandsynligvis grundlaget for den vasodilaterende effekt i hjernen og promovering af nimodipin, der observeres hos dyr og mennesker.
Dens terapeutiske egenskaber er relateret til evnen til at hæmme sammentrækningen af den glatte muskelcelle induceret af calciumioner.
Ved brug af nimodipin kan vasokonstriktion induceres in vitro af forskellige vasoaktive stoffer (såsom serotonin, prostaglandiner, histamin) og vasokonstriktion forårsaget af blodet eller dets nedbrydningsprodukter. Nimodipine udøver også neuro- og psykofarmakologiske virkninger. Forskning foretaget ude hos patienter, der lider af akutte cerebrovaskulære lidelser, har vist, at nimodipin udvider cerebrale kar og øger cerebral blodgennemstrømning, som normalt øges mere konsekvent i de skadede og hypoperfusionerede cerebrale distrikter, end i de sunde områder. Andre undersøgelser har vist, at dette fører ikke til stjæle fænomener.Med brug af nimodipin opnås en signifikant reduktion i iskæmiske neurologiske underskud og dødelighed som følge af vasospasme fra subarachnoid blødning af aneurysmal oprindelse.
Forbedringen er kun signifikant hos patienter med subaraknoid blødning cerebral vasospasme. Der er påvist koncentrationer af nimodipin op til 12,5 ng / ml i cerebrospinalvæsken hos patienter behandlet for subarachnoid blødning.
Nimodipin har klinisk vist sig at forbedre hukommelses- og koncentrationsbesvær hos patienter med nedsat hjernefunktion.
Andre typiske symptomer påvirkes også positivt, hvilket fremgår af evalueringen af det samlede kliniske indtryk, evalueringen af individuelle lidelser, observation af adfærd og psykometriske tests.
05.2 "Farmakokinetiske egenskaber
Absorption
Det aktive stof nimodipin, administreret oralt, absorberes praktisk talt fuldstændigt.
Det uændrede aktive stof og dets første first-pass metabolitter påvises i plasmaet så tidligt som 10-15 minutter efter indtagelse af tabletten.
Efter flere orale doser (3 x 30 mg / dag) er maksimal plasmakoncentration (Cmax) hos ældre 7,3-43,2 ng / ml og nås efter 0,6-1, 6 timer (tmax).
Enkeltdoser på 30 mg og 60 mg hos unge forsøgspersoner opnår gennemsnitlige maksimal plasmakoncentrationer på henholdsvis 16 8 ng / ml og 31 12 ng / ml.
Den maksimale plasmakoncentration og området under koncentration / tidskurven øger dosis proportionalt op til den maksimale undersøgte dosis (90 mg).
Gennemsnitlige steady -state plasmakoncentrationer på 17,6 - 26,6 ng / ml opnås efter i.v. kontinuerlig på 0,03 ng / kg / t. Efter i.v. bolus plasmakoncentrationer af nimodipin falder bifasisk med halveringstider på 5-10 minutter og cirka 60 minutter. Det beregnede fordelingsvolumen (Vss i to-rums modellen) for i.v. resultater på 0,9 - 1,6 l / kg kropsvægt. Total systemisk clearance er 0,6 - 1,9 l / t / kg.
Proteinbinding og distribution
Nimodipin er 97-99% bundet til plasmaproteiner.
I forsøgsdyret behandlet med 14C-mærket nimodipin krydser radioaktiviteten placentabarrieren.
En lignende fordeling er sandsynligvis også hos kvinder, selvom der mangler eksperimentelle beviser i denne forstand.
Hos rotter forekommer nimodipin og / eller dets metabolitter i mælk ved en meget højere koncentration end i moderplasma. Hos kvinder forekommer det uændrede lægemiddel i mælk ved koncentrationer af samme størrelsesorden som i moderplasma.
Efter oral og intravenøs administration kan nimodipin doseres i cerebrospinalvæsken ved koncentrationer svarende til ca. 0,5% af dem, der findes i plasma.
Disse svarer omtrent til koncentrationerne af frit aktivt stof i plasmaet.
Metabolisme, eliminering og udskillelse
Metabolismen af nimodipin sker gennem cytochrom P450 3A4 -systemet, hovedsageligt gennem dehydrogenering af dihydropyridinringen og oxidativ deesterificering af esteren, som ved hydroxylering af ethylgrupper 2 og 6 og glucuronidering repræsenterer et af de yderligere vigtige metaboliske trin.
De tre primære metabolitter, der forekommer i plasma, besidder terapeutisk ubetydelig eller nul "restaktivitet".
Virkningerne af induktion og inhibering på leverenzymer er ukendte. Hos mennesker udskilles cirka 50% af metabolitterne via nyrerne og 30% i galden.
Elimineringens kinetik er lineær. Halveringstiden for nimodipin er mellem 1,1 og 1,7 timer. Den terminale halveringstid på 5-10 timer er ikke relevant ved bestemmelse af intervallet mellem doser.
Gennemsnitlige plasmakoncentrationskurver for nimodipin efter oral administration af 30 mg i tabletformuleringen og efter i.v. på 0,015 mg / kg i 1 time (n = 24 ældre frivillige).
Biotilgængelighed
Efter det relevante first-pass metabolisme (ca. 85-95%) er den absolutte biotilgængelighed 5-15%.
05.3 Prækliniske sikkerhedsdata
Ikke-kliniske data afslører ingen særlig fare for mennesker baseret på konventionelle undersøgelser af sikkerhedsfarmakologi, toksicitet ved gentagen dosis, gentoksicitet, kræftfremkaldende potentiale, reproduktionstoksicitet. Hos rotter hæmmede doser på 30 mg / kg / dag eller højere, administreret under graviditeten, fostrets vækst, hvilket resulterede i et fald i fostervægt. En dosis på 100 mg / kg / dag var dødelig for fosteret. Der var ingen tegn på teratogenicitet. Hos kaniner blev der ikke observeret embryotoksicitet og teratogenicitet op til en dosis på 10 mg / kg / dag. I et peri-postnatal studie med rotter blev der observeret dødelighed og forsinkelse i fysisk udvikling ved doser på 10 mg / kg / dag eller mere. Disse resultater blev ikke bekræftet af efterfølgende undersøgelser.
Akut forgiftning
Tabel 3
Forskellen mellem LD50 -værdierne efter oral og intravenøs administration indikerer, hvordan absorptionen af den aktive ingrediens efter administration af høje doser af en oral suspension er ufuldstændig eller forsinket.
Symptomer på forgiftning efter oral administration blev kun observeret hos mus og rotter og er repræsenteret ved let cyanose, svær nedsat motilitet og dyspnø.
Efter IV-administration blev disse tegn på forgiftning forbundet med tonisk-kloniske anfald observeret hos alle undersøgte arter.
Subkroniske tolerabilitetsundersøgelser
Undersøgelser udført på hunde med en oral dosis på 10 mg / kg resulterede i nedsat kropsvægt, nedsat hæmatokrit, hæmoglobin og erytrocytter; øget puls og ændringer i blodtrykket.
Undersøgelser af kronisk tolerabilitet
Orale doser op til ca. 90 mg / kg / dag i to år tolereredes godt af musen.
I et 1-årigt studie med hunde blev den systemiske tolerabilitet af nimodipindoser op til 6,25 mg / kg / dag undersøgt.
Doser på op til 2,5 mg / kg viste sig at være ufarlige, mens 6,25 mg / kg forårsagede elektrokardiografiske ændringer på grund af forstyrrelser i myokardiel blodgennemstrømning. Imidlertid blev der ikke fundet nogen histopatologiske ændringer i hjertet ved denne dosering.
Undersøgelser af reproduktionstoksicitet
Fertilitetsundersøgelser hos rotter
Doser på op til 30 mg / kg / dag påvirkede ikke fertiliteten hos han- og hunrotter eller efterfølgende generationer.
Embryotoksicitetsundersøgelser
Administration af 10 mg / kg / dag til hunrotten under embryogenese afslørede ingen skadelige virkninger, mens doser på 30 mg / kg / dag og mere hæmmede vækst, der inducerede en reduceret fostervægt og, ved 100 mg / kg / dag, inducerede en stigning i intrauterine embryonale dødsfald.
Embryotoksicitetsundersøgelser udført på kaniner med orale doser op til 10 mg / kg / dag viste ingen teratogene eller embryotoksiske virkninger.
Perinatal og postnatal udvikling hos rotter
For at evaluere perinatal og postnatal udvikling blev der udført undersøgelser hos rotter med doser på op til 30 mg / kg / dag.
I en undersøgelse med 10 mg / kg / dag og mere blev der observeret en stigning i både perinatal og postnatal dødelighed og forsinket fysisk udvikling. Disse resultater blev ikke bekræftet af efterfølgende undersøgelser.
Specifikke tolerabilitetsundersøgelser
Kræftfremkaldende
I et livstidsstudie med rotter, behandlet i 2 år med doser op til 1800 dele pr. Million (ca. 90 mg / kg / dag) i foder, blev der ikke påvist et onkogent potentiale.
Lignende resultater blev opnået hos mus behandlet i 21 måneder i et langtidsstudie med 500 mg / kg / dag oralt.
Mutagenese
Nimodipin er blevet valideret i talrige mutagenicitetsundersøgelser, som ikke viste signifikante mutagene virkninger, geninduktion og kromosomale mutationer.
06.0 LÆGEMIDDELOPLYSNINGER
06.1 Hjælpestoffer
Overtrukne tabletter
mikrogranulær cellulose, povidon, crospovidon, magnesiumstearat, majsstivelse, hypromellose, macrogol 4000, titandioxid (E171), gult jernoxid (E172)
Orale dråber, opløsning
hydrogeneret polyvalent ricinusolie, ethylalkohol
06.2 Uforenelighed
Ingen kendte.
06.3 Gyldighedsperiode
Overtrukne tabletter: 5 år.
Orale dråber, opløsning: 5 år.
06.4 Særlige opbevaringsforhold
Overtrukne tabletter: Denne medicin kræver ingen særlige opbevaringsbetingelser
Orale dråber, opløsning: beskyttes mod lys / må ikke nedkøles
06.5 Den umiddelbare emballages art og emballagens indhold
Tabletter:
36 tabletter
PVC / aluminium eller PVC-PVDC / aluminium eller PP blister
Orale dråber, opløsning:
orale dråber, opløsning: 25 ml flaske brun glasflaske med skruelåg og glasdråber
06.6 Brugsanvisning og håndtering
Ingen særlige instruktioner
07.0 INDEHAVER AF MARKEDSFØRINGSTILLADELSE
Bayer S.p.A. - Viale Certosa, 130 - Milano
08.0 MARKEDSFØRINGSTILLADELSESNUMMER
NIMOTOP 30 mg overtrukne tabletter
AIC 026403016
NIMOTOP 30 mg / 0,75 ml orale dråber, opløsning
AIC 026403055
09.0 DATO FOR FØRSTE TILLADELSE ELLER FORNYELSE AF TILLADELSEN
Første godkendelse: 27.07.87 (på markedet siden oktober 1987)
Godkendelse af godkendelse: juni 2010